近日,我院吉训明院士/刘佳副教授团队在eLife期刊发表题为“Brain-derived exosomal hemoglobin transfer contributes to neuronal mitochondrial homeostasis under hypoxia”的研究论文,首次揭示了缺氧状态下脑内细胞间通过外泌体转运血红蛋白实现“互助”适应的分子机制。2024级神经生物学专业博士研究生田正明为第一作者,刘佳副教授、吉训明院士为共同通讯作者。
缺氧是常见的生理应激因素,广泛参与卒中、阿尔茨海默病和帕金森病等多种神经系统疾病的发生发展。然而,大脑在缺氧条件下如何调节细胞间通讯以抵御神经损伤,其具体机制仍不清晰,限制了相关干预策略的开发。该研究通过多组学联合分析,发现缺氧脑组织中非神经元细胞可通过外泌体将血红蛋白mRNA传递至神经元,并在神经元中被转录表达。进一步在体外实验中证实,缺氧促进了内皮细胞-神经元之间外泌体血红蛋白的转运,并发挥了维持神经元线粒体稳态、保护其免受损伤的关键作用。

在这项研究中,体内实验结果显示,慢性低氧可诱导脑中非神经元细胞大量转录血红蛋白,并通过外泌体通讯传递至神经元,促进其表达,从而增强其抗缺氧能力。
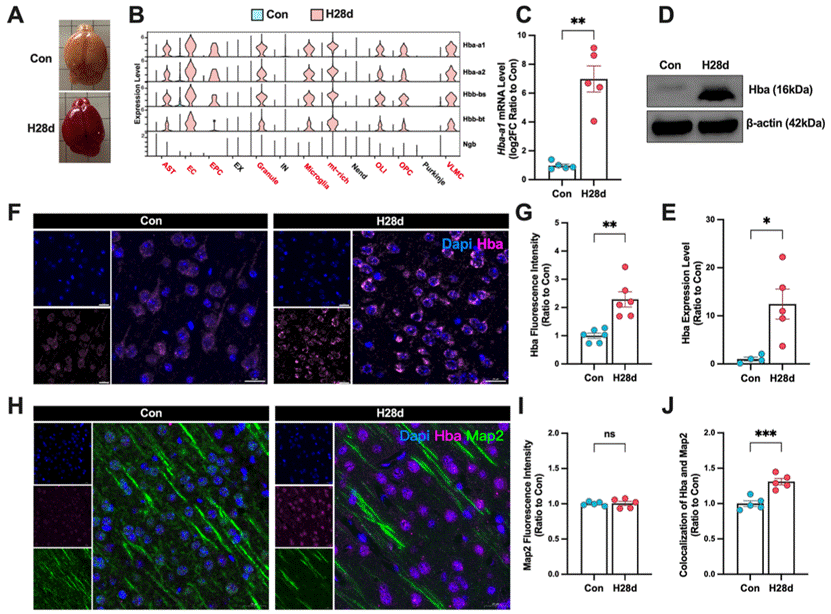
图1:慢性缺氧诱导小鼠脑中神经元内大量表达血红蛋白
在体外实验中,研究者将经低氧处理的内皮细胞来源外泌体转移至神经元,并证实该过程通过上调神经元血红蛋白、稳定线粒体功能实现保护作用。
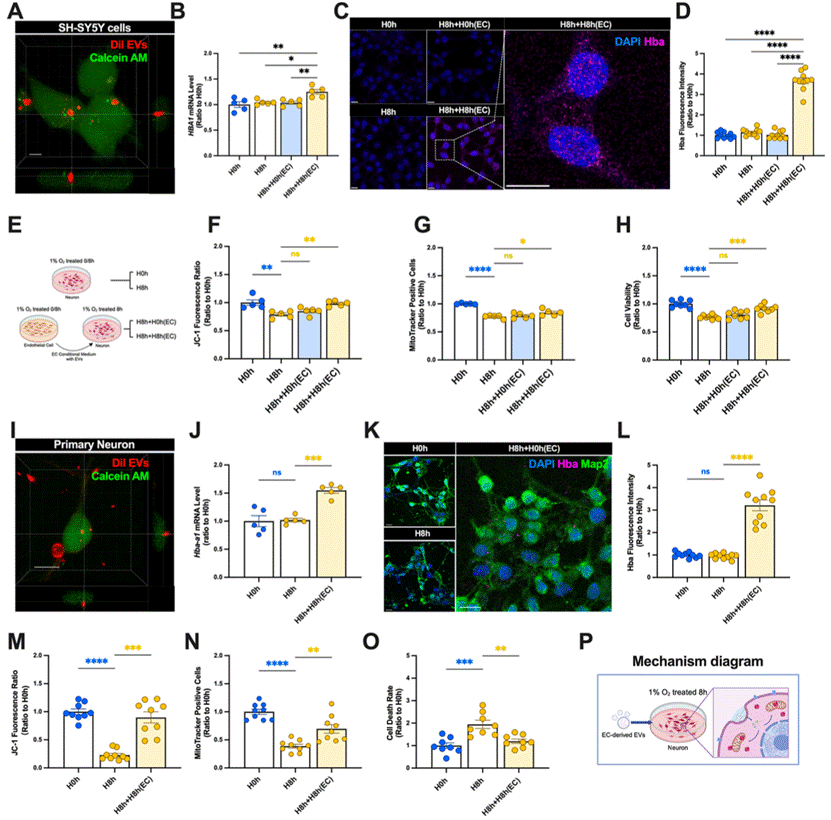
图2:内皮细胞来源外泌体通过上调神经元血红蛋白表达,维持线粒体稳态以抵御低氧损伤
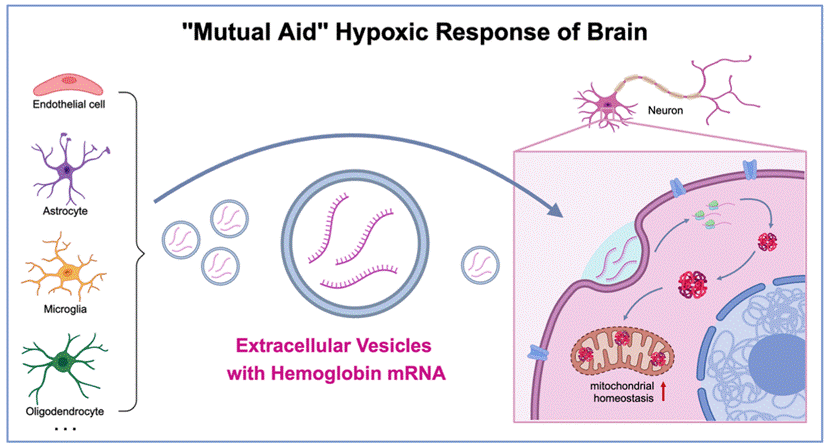
该研究首次提出“大脑缺氧应激下的外泌体血红蛋白互助机制”,揭示了细胞间通讯在脑缺氧损伤应答过程中的关键作用,拓展了非循环系统血红蛋白的功能认知,为缺氧相关脑病的干预提供了全新研究思路与治疗策略。
刘佳,博士,副教授,硕士研究生导师,北京市科技新星。长期从事低氧参与脑损伤的分子机制及干预研究,着重关注间歇性低氧适应在低氧相关脑疾病中的干预效果及机制。担任SCI 杂志CNS Neuroscience & Therapeutics、Brain Circulation 编委,Neurobiology of Disease、Journal of neuroscience等杂志审稿人,中国神经科学学会神经退行性疾病分会委员,心血管病精准医学分会委员。主持国家自然科学基金、北京市科技新星、首都医学科学创新中心等项目。荣获张锡钧基金全国青年优秀生理学学术论文奖,北京市优秀毕业生等。以第一作者或通讯作者身份共参与发表SCI 论文近30篇,主要成果发表在Autophagy、J Cereb Blood Flow Metab、Cell Death & Dis、Elife、Cell Death Discov、Aging Dis等期刊上,被引1000 余次,H 因子16。


